
Efficacité
EVKEEZAMD a réduit de moitié le taux de C-LDL après 24 semaines en association avec un régime pauvre en gras et d’autres traitements hypolipidémiants1,2
- Jusqu’à la semaine 24
- Jusqu’à la semaine 48
EVKEEZA peut réduire les taux de C-LDL d’environ 50 % lorsqu’il est ajouté aux traitements standards actuels1,2 (variation absolue de -3,4 mmol/L; différence moyenne des MC; IC à 95 % : [-65 %;-33 %]; n = 65; p < 0,0001)
Les réductions du C-LDL se sont maintenues pendant la période de traitement au su jusqu’à la semaine 481*
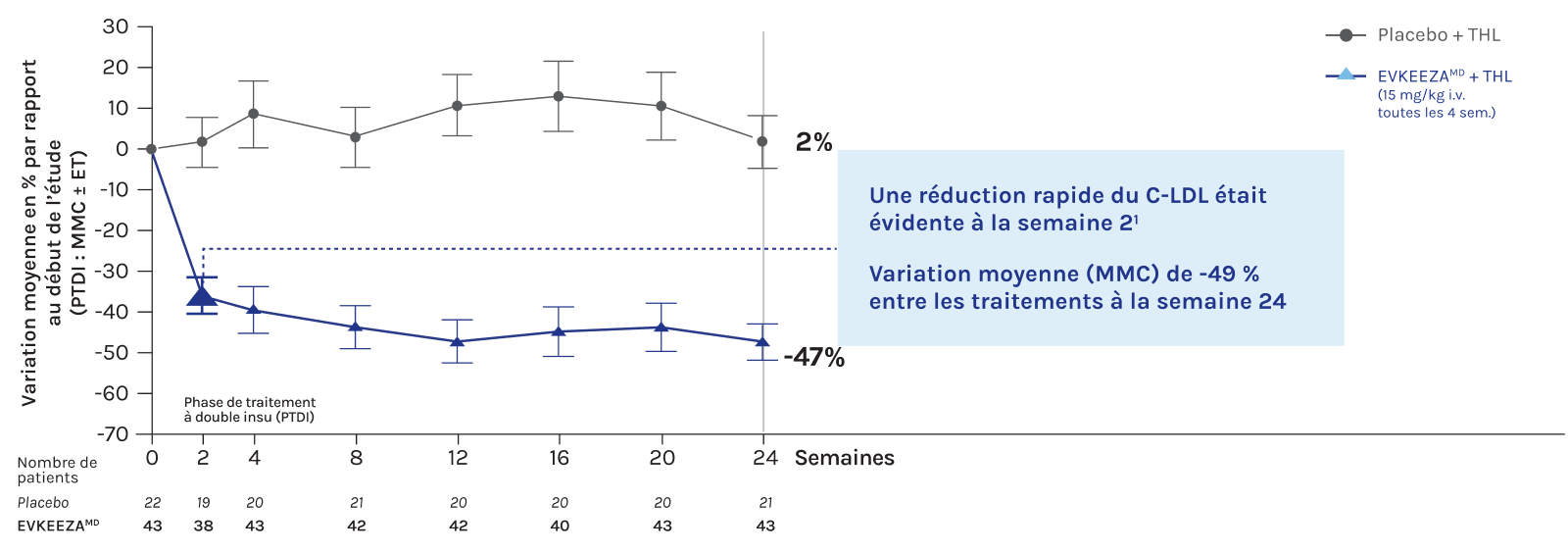
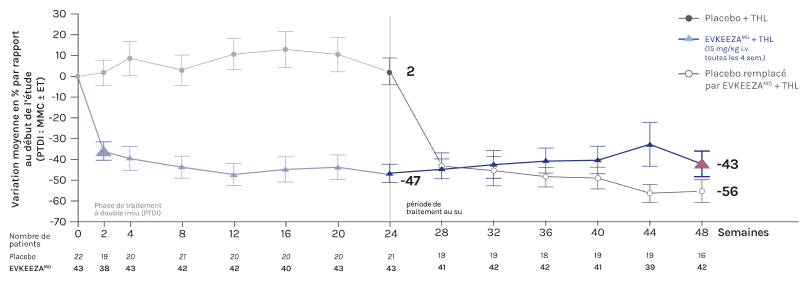
* Après la période de traitement à double insu, 64 des 65 patients répartis aléatoirement qui ont participé à la période de traitement sans insu ont reçu de l’évinacumab. À la semaine 48, la variation moyenne en pourcentage du taux de C-LDL par rapport au début de l’étude allait de -42,7 % à -55,8 %1.
Adaptation de Raal et coll. (2020 et 2023).
Les réductions du C-LDL étaient similaires, quel que soit le traitement de fond2
| Traitement de fond au départ | Sans traitement de fond au départ | |||
|---|---|---|---|---|
| Traitement de fond au départ, moyenne (É.-T.) | EVKEEZA 15 mg/kg i.v. toutes les 4 sem., % (É.-T.) | Placebo i.v. toutes les 4 sem., % (É.-T.) | EVKEEZA 15 mg/kg i.v. toutes les 4 sem., % (É.-T.) | Placebo i.v. toutes les 4 sem., % (É.-T.) |
| Statin | -47% (31), N=61 | 2% (32), N=61 | -46% (11), N=4 | -6% (23), N=4 |
| Ézétimibe | -53% (21), N=49 | -2% (31), N=49 | -28% (46), N=16 | 12% (34), N=16 |
| Lomitapide | -50% (23), N=14 | -17% (48), N=14 | -46% (32), N=51 | 5% (28), N=51 |
| Inhibiteur de PCSK9 | -50% (32), N=50 | 2% (30), N=50 | -39% (20), N=15 | 1% (36), N=15 |
| Aphérèse | -46% (18), N=22 | -7% (34), N=22 | -48% (34), N=43 | 7% (29), N=43 |
Adaptation de Raal et coll. (2020).
~70 % des patients prenant EVKEEZA ont reçu 3 THL de fond pendant l’essai clinique2
La proportion de patients de l’essai avec placebo qui prenaient au moins trois THL était de 50 %.
ELIPSE-HFHo
Une étude de phase 3 multicentrique, à double insu, à répartition aléatoire, en groupes parallèles et contrôlée par placebo menée chez des patients âgés de 12 ans et plus atteints de HFHo. Les patients suivaient des traitements de fond hypolipidémiants, notamment par des statines à la dose maximale tolérée, de l’ézétimibe, des anticorps inhibiteurs de la PCSK9 et l’aphérèse des lipoprotéines. Au cours de la période de traitement à double insu, 43 patients ont été répartis au hasard pour recevoir EVKEEZA à raison de 15 mg/kg par voie i.v. toutes les 4 semaines et 22 patients ont reçu le placebo. Pendant la période de traitement au su, 64 patients ont reçu EVKEEZA à 15 mg/kg i.v. toutes les 4 semaines1.

Profil d’innocuité
EVKEEZA a un profil d’innocuité démontré1,2
De l’hypersensibilité, y compris de l’anaphylaxie et des réactions à la perfusion (prurit), a été signalée. Si cela se produit, cesser le traitement et traiter en suivant la norme de soins.
Les femmes en âge de procréer doivent utiliser une méthode de contraception efficace pendant le traitement par EVKEEZA et pendant au moins 5 mois après la dernière dose.
| Effets indésirables chez les patients atteints de HFHo recevant EVKEEZA dans des essais cliniques contrôlés par placebo1 | |||
|---|---|---|---|
| Classe de système d’organes | Terme privilégié |
Toutes doses i.v. d’EVKEEZA* n = 117 (%) |
Placebo i.v. toutes les 4 sem. n = 54 (%) |
| Troubles gastrointestinaux | Nausée | 5 | 1,9 % |
| Douleur abdominale | 3 | 1,9 % | |
| Constipation | 3 | 0 % | |
| Troubles généraux et anomalies au point d’administration Infections et infestations | Maladie pseudogrippale | 8 | 5,6 % |
| Asthénie | 3 | 0 % | |
| Infusion site pruritus | 2 | 0 % | |
| Troubles du système immunitaire | Anaphylaxie | 1 | 0 % |
| Infections et infestations | Rhinopharyngite | 14 | 13 % |
| Infection des voies respiratoires supérieures | 3 | 0 % | |
| Troubles musculosquelettiques et du tissu conjonctif | Dorsalgie | 5 | 3,7 % |
| Douleur aux extrémités | 5 | 0 % | |
| Troubles du système nerveux | Étourdissements | 6 | 0 % |
| Troubles respiratoires, thoraciques et médiastinaux | Rhinorrhée | 3 | 0 % |
* Toutes les doses i.v. d’EVKEEZA englobent les données sur la dose de 5 mg/kg par voie intraveineuse toutes les 4 semaines de l’étude R1500-CL-1643, plus celles sur la dose 15 mg/kg i.v. toutes les 4 sem. de la période de traitement à double insu des études R1500-CL-1643 et R1500-CL-1629.
C-LDL : cholestérol à lipoprotéines de basse densité; ET : erreur type; É.-T. : écart-type; IC : intervalle de confiance; LDLR : récepteur des LDL; MC : moindres carrés; PCSK9 : proprotéine convertase subtilisine/kexine de type 9; PTDI : phase de traitement à double insu; THL : traitement hypolipidémiant.
Références :
- Monographie de produit d’EVKEEZAMD. Ultragenyx Pharmaceutical, Inc., 2023.
- Raal, F.J., Rosenson, R.S., Reeskamp, L.F., et coll. « Evinacumab for homozygous familial hypercholesterolemia », N Engl J Med, 2020;383(8) :711-720.
- Wiegman, A., et coll. « Efficacy and safety of evinacumab in paediatric patients with HoFH, Results from Part B of the 17100 phase 3 trial », présenté au 5e symposium de l’EAS sur l’hypercholestérolémie familiale pédiatrique; Milan, Italie; 21 mai 2022.
Chez les enfants âgés de 5 à 11 ans, EVKEEZA peut réduire les taux de C-LDL de 48 % en complément des traitements standards actuels1,3 (variation absolue de -3,42 mmol/L; n = 14; IC à 95 % : [-68 %;-27.8 %])
Les traitements standards actuels sont :
- Les statines
- L’ézétimibe
- Les inhibiteurs de PCSK9*
- Le lomitapide
- L’aphérèse
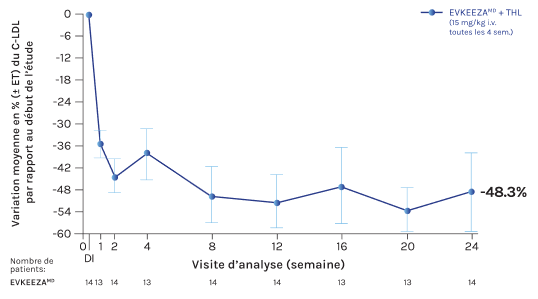
Adaptation de Wiegman et coll. (2024).
* Critère d’évaluation principal; données brutes, car il n’y avait pas de données manquantes au moment de l’évaluation primaire de l’efficacité (à 24 semaines).
* Les inhibiteurs de PCSK9 ont été permis dans le cadre de l’étude, toutefois aucun patient n’y a participé dans la même étude
L’effet réducteur sur le C-LDL était similaire quel que soit le recours à l’aphérèse ou le statut du LDLR4
L’étude R1500-Cl-17100 est une étude ouverte, multicentrique, en trois parties, à un seul groupe de traitement, visant à évaluer l’efficacité, l’innocuité et la tolérabilité d’EVKEEZA chez des patients pédiatriques (de 5 à 11 ans) atteints de HFHo. L’étude comprend trois parties : la partie A, la partie B et la partie C. La partie A est une étude sans insu à dose unique visant à évaluer l’innocuité, la pharmacocinétique et la pharmacodynamique d’EVKEEZA à 15 mg/kg par voie i.v. chez 6 patients atteints de HFHo, suivie d’une période observationnelle de 16 semaines pour déterminer la dose pour le reste de l’étude. La partie B est une période de traitement sans insu de 24 semaines à un seul groupe de traitement évaluant l’efficacité et l’innocuité d’EVKEEZA à 15 mg/kg par voie i.v. toutes les 4 semaines chez 14 patients atteints de HFHo. La partie C est une étude de prolongation de la partie A et de la partie B visant à évaluer l’innocuité à long terme d’EVKEEZA à 15 mg/kg par voie i.v. toutes les 4 semaines chez 20 patients atteints de HFHo. Il s’agit d’une période de traitement de 48 semaines et d’une période de suivi de 24 semaines (en cours). Les patients de la partie C ont été inscrits directement à partir de la partie A ou de la partie B.

Profil d’innocuité
EVKEEZA présente un profil d’innocuité démontré chez les enfants de 5 à 11 ans1-4
Le profil d’innocuité d’EVKEEZA observé chez ces patients était conforme au profil d’innocuité observé chez les patients adultes et adolescents âgés de 12 ans et plus, avec de la fatigue comme effet indésirable supplémentaire. La fatigue a été signalée chez 3 patients pédiatriques (15 %).
| Réactions indésirables | n (%) |
|---|---|
| Douleur oropharyngée | 3 (21,4) |
| Fatigue | 3 (15) |
| Douleur abdominale haute | 2 (14,3) |
| Diarrhée | 2 (14,3) |
| Céphalées | 2 (14,3) |
| Rhinopharyngite | 2 (14,3) |
Un patient a connu un événement allergique généralisé caractérisé par une éruption cutanée et une dermatite de contact, qui étaient bénignes et n’ont pas entraîné l’arrêt du traitement; il n’y a pas eu d’événements comprenant des troubles hépatiques.
C-LDL : cholestérol à lipoprotéines de basse densité; ET : erreur type; É.-T. : écart-type; IC : intervalle de confiance; LDLR : récepteur des LDL; MC : moindres carrés; PCSK9 : proprotéine convertase subtilisine/kexine de type 9; PTDI : phase de traitement à double insu; THL : traitement hypolipidémiant.
Références :
- Monographie de produit d’EVKEEZAMD. Ultragenyx Pharmaceutical, Inc., 2023.
- Raal, F.J., Rosenson, R.S., Reeskamp, L.F., et coll. « Evinacumab for homozygous familial hypercholesterolemia », N Engl J Med, 2020;383(8) :711-720.
- Wiegman, A., et coll. « Efficacy and safety of evinacumab in paediatric patients with HoFH, Results from Part B of the 17100 phase 3 trial », présenté au 5e symposium de l’EAS sur l’hypercholestérolémie familiale pédiatrique; Milan, Italie; 21 mai 2022.
- Raal, F., R. Rosenson, L. Reeskamp et coll. « The Long Term Efficacy and Safety of Evinacumab in Patients with Homozygous Familial Hypercholesterolemia », JACC Adv, novembre 2023, 2(9).
- Adam, R.C., I.J. Mintah, C.A. Alexa-Braun et coll. « Angiopoietin-like protein 3 governs LDL-cholesterol levels through endothelial lipase-dependant VLDL clearance », J Lipid Res, 2020;61(9) :1271 - 1286.
- Wiegman, A., et coll. « Evinacumab for pediatric patients with homozygous familial hypercholesterolemia », Circulation, 2024;149(5):343 - 353.



